科学を信じて扉を開く
~病気の本質を突く革新的な開発研究~
- 複合ウィルス療法研究
-
がん破壊アデノウイルスで 患者さんにやさしい治療法を開発します。
がんのウイルス療法
従来の抗がん剤や放射線を使った治療法では治りにくいがん細胞が存在し、新しいがん治療法の開発が強く求められています。 私たちは治りにくいがん細胞を治療するためにがん破壊アデノウイルス「テロメライシン」を開発しました。テロメライシンはがん細胞の無限な増殖能に関わるテロメラーゼによってがん細胞で選択的に増殖するアデノウイルスです。 テロメライシンががん細胞に入ると、テロメラーゼ活性によってテロメライシンは急速に増殖してがん細胞を破壊します。 テロメライシンは従来の抗がん剤や放射線が効きにくいがん細胞にも治療効果を発揮します。テロメライシンは正常細胞を傷つけずにがん細胞だけを破壊することから、がん患者さんにやさしいがん治療法の開発が期待されています。
テロメライシン(開発コード:OBP-301)
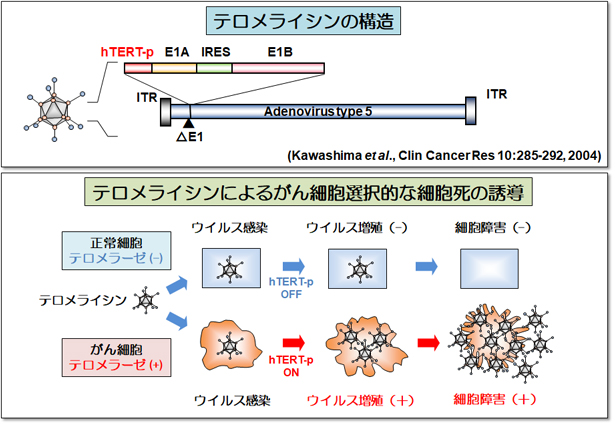
がんの複合ウイルス療法
テロメライシンは抗がん剤や放射線の治療効果を高めることが研究でわかってきました。テロメライシンががん細胞に入ると、抗がん剤や放射線の効果を阻害するタンパク質を抑制して抗がん剤や放射線の治療効果を高めることができます。現在、食道がん患者さんを対象にテロメライシンと放射線併用の複合ウイルス療法の臨床試験を行っています。
がん細胞は免疫チェックポイントPD-1/PD-L1を介して免疫細胞の攻撃を回避します。免疫療法は手術、抗がん剤、放射線に続く第4の治療として注目されています。テロメライシンに免疫細胞を活性化する効果があることを確認しました。現在、食道がん患者さんを対象にテロメライシンと抗PD-1抗体の複合ウイルス療法の臨床試験を行っています。テロメライシン臨床試験の実施
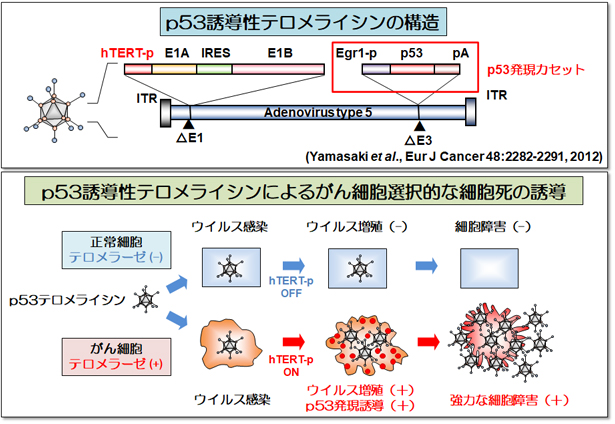
がんのp53遺伝子治療
がん細胞の増殖を最も強く抑制するがん抑制遺伝子にp53があります。p53は転写調節因子として様々な下流遺伝子を調節してがん細胞の増殖を抑制します。私たちは1999年に日本で初めて肺がん患者さんにp53遺伝子治療を行いました。 一部の患者さんで治療効果を確認しましたが、がんを完全に治療することはできませんでした。そこでp53遺伝子治療の効果を高めるために、p53誘導性テロメライシンを開発しました。p53誘導性テロメライシンは従来のp53誘導性非増殖型アデノウイルスよりも強力な治療効果を示すことを確認しました。現在、がん患者さんに投与するためのp53誘導性テロメライシンの製造を行っており、将来的ながん患者さんへのp53遺伝子治療を計画中です。
p53誘導性テロメライシン(開発コード:OBP-702)
- がん微小環境研究
-
消化器癌における『がん微小環境』を
標的とした新しい治療法の創生がん関連線維芽細胞の研究 がん進展への多角的な貢献
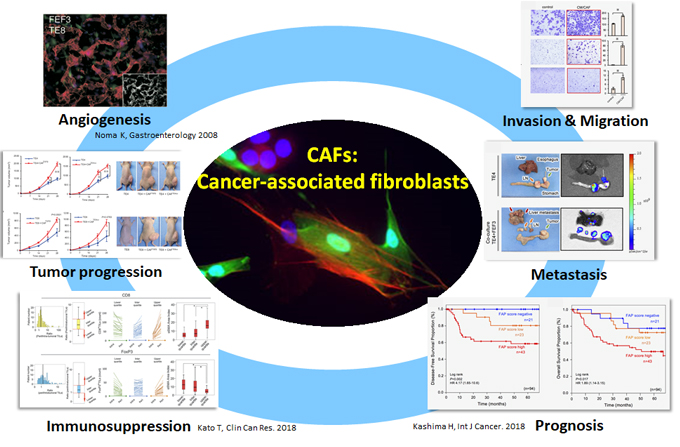
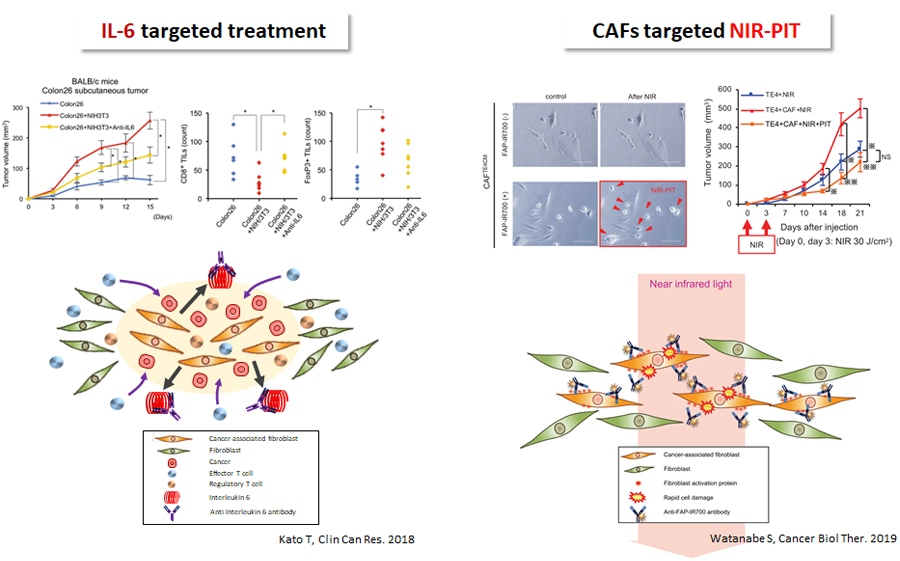
近年、従来の抗癌剤とは異なる、分子や免疫チェックポイントを標的とした革新的な治療薬が報告されています。一方で、がん種によっては有効でない場合も多く報告され、がん微小環境が重要な役割を果たすと考えられています。我々は、以前よりがん微小環境を治療の標的とし、その中心的役割を担うCancer-associated fibroblasts (CAFs)の機能解析を行い、CAFsが、がんの増殖・浸潤・転移に貢献し、さらにがん微小環境を免疫抑制状態へと誘導して、予後を不良にしていることを明らかにしました。さらにそこではCAFsの産生するInterleukin-6(IL-6)が重要な役割を果たしていることを解明し、特にIL-6に着目した治療開発を行っております。
また、近年では、近赤外光線免疫療法 (Near Infrared Photoimmunotherapy; NIR-PIT)を用いたCAFsを標的とする治療開発を行っています。NIR-PITは米国立がん研究所の小林久隆医師が開発した治療法で、細胞表面に結合した抗体 IR700 結合体に近赤外光を照射すると、IR700に起こる化学反応によって免疫原性細胞死が惹起され、特異的な細胞死を誘導します。我々は、小林医師との共同研究で、CAFsに発現するFibroblast Activation Protein (FAP)を標的とし、NIR-PITによりCAFs細胞自体を選択的に排除する治療法開発を行ってきました。本治療法は従来の抗癌剤とは異なる、新たなアプローチのがん微小環境を標的とした治療法です。
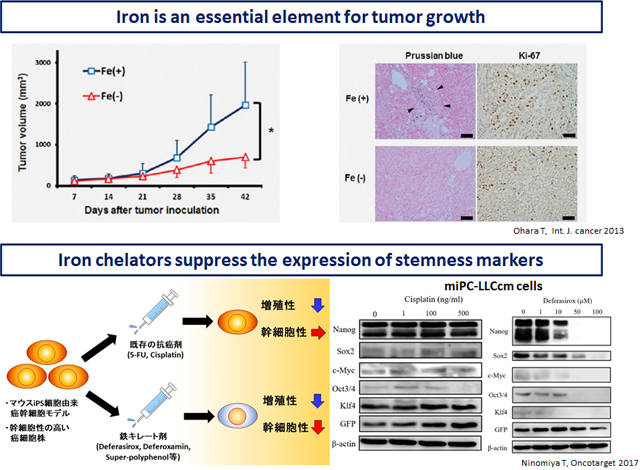
その他、がん細胞は周囲の微小環境から様々な影響を受ける事が知られていますが、細胞以外にも微量元素からも大きな影響を受けています。鉄は地球の誕生と共に存在し、生体と強い結びつきがあり、がん細胞も高度に鉄を利用しています。特にがんの根源と考えられているがん幹細胞は鉄依存性が高く、私達は2017年にiPS細胞由来の癌幹細胞モデルを用いて、鉄キレート剤を投与すると癌幹細胞の幹細胞性が喪失する事を初めて報告し、さらに通常の消化器癌の癌細胞株でも幹細胞性の高いものは同様の効果が認められています。
我々はこれらいくつかのがん微小環境への新しいアプローチで、これまで治療困難ながんに対する新しい治療法の開発研究を行っています。がん関連線維芽細胞を標的とした治療開発
がん微小環境内の鉄代謝を標的とした治療開発
- 好中球・がん病態研究
-
がんの炎症性微小環境を理解し、
新規治療の手がかりを探る癌細胞はシャーレの上の培養では、抗癌剤、放射線、ウイルス製剤等で容易に死滅させられるにも関わらず、動物に移植し腫瘍を形成すると例え小さな腫瘍であっても、完全に消滅させることは困難になります。臨床ではなおさら手術で完全切除できなかった、あるいは再発した消化器癌を根治させることは極めて難しい。その理由と解決策が癌を形成する炎症性微小環境にあるかもしれないと考え、研究を行っております。
当グループは胃癌の腹膜播種に関連する研究が始まりですが (Ishida, Mol Cancer Ther, 2015) (Wanatabe, Cancer Sci, 2018)、腹腔内には癌細胞の他にも免疫系細胞や中皮細胞等が存在しており、癌細胞はそれらの細胞と接しながらも転移を形成していくことから、癌細胞と癌微小環境との相互関係性へと研究テーマが進んでまいりました。マクロファージが癌細胞の悪性形質に影響を及ぼし、化学療法抵抗性を獲得し(Kuwada, J Exp Clin Cancer Res, 2018)、その介在因子としてIL-6(Sakamoto, OncoImmunol, 2019)や細胞外小胞体が関与していること(Ito, BMS Cancer, 2021)などを報告しました。また、最近では好中球と癌の関係にも着目し、好中球が起こすNeutrophil Extracellular Traps (NET)という現象が癌の転移に関わること、それを既存医薬品のdrug repurposingによってNETを抑制する可能性を報告しています(Kajioka, Cancer Lett, 2021)。また癌細胞が好中球にNETを起こす際に血小板の関与があることから、抗血小板薬によるそれの抑制の可能性を見出しました(Yoshimoto, Cancer Lett, 2023)。このように、現在、癌の炎症性微小環境がいかに悪性形質に影響を及ぼすかを研究し、その中で治療成績の改善に役立つような現実的な解決策を見つけるべく、研究を進めています。
臨床医である大学院生が大学院での癌研究を通じて、課程修了後にはこれまでと違う視点や思考を持って臨床現場でしなやかに対処できるようにと願い、また外科治療で治らない癌をいつの日か克服できるようになるようにと夢を馳せつつ研究を進めています。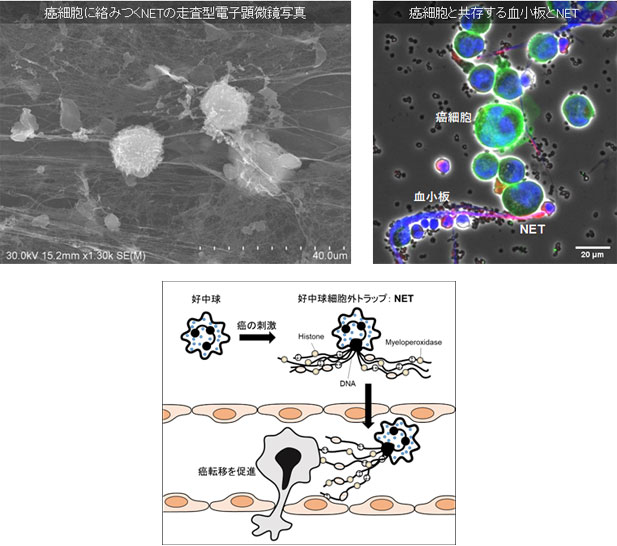
- プレシジョン医療研究
-
~最適な医療を患者さんに届けたい。
その思いを現実に~次世代シークエンサーや人工知能(AI)などの技術革新に基づいたゲノム医療の進展に伴い、患者さんひとりひとりに最適な治療法を提供する「プレシジョン医療(精密医療)」が現実のものとなりました。私たちの研究グループは、ゲノミクス、エピゲノミクス、イメージングなど、多方面からアプローチすることで、このプレシジョン医療をさらに加速させていきたいと考えています。以下の3部門が協力し研究を進めています。
プレシジョン医療 (精密医療)
ゲノミクス・エピゲノミクス解析部門
① 消化器癌におけるRNA編集の解析
RNA編集
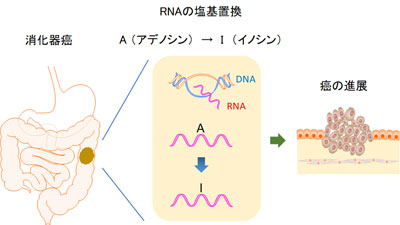 近年、癌組織においては、DNAレベルの遺伝子変異のみならず、RNAの塩基配列も変化し、癌の進展に寄与していることが判明し、RNA編集と呼ばれています。
近年、癌組織においては、DNAレベルの遺伝子変異のみならず、RNAの塩基配列も変化し、癌の進展に寄与していることが判明し、RNA編集と呼ばれています。
RNA編集を解析することで、発癌や予後の予測のみならず、癌治療への応用を目指しています。② 胆道・膵臓癌における予後予測マーカーの探索
胆道・膵臓癌は、近年増加傾向の予後不良な消化器癌です。
切除標本・血液サンプルを解析し予後予測マーカーを探索しています。また中国・四国地方の関連病院からなる多施設共同研究で、患者さんの臨床検体とともにデータベースを構築し、新しい治療法につながる臨床研究・基礎研究を進めています。胆道癌における予後予測マーカーの探索
イメージング部門
上皮間葉形質転換(EMT)可視化細胞の樹立
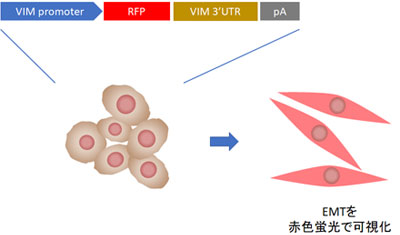 上皮間葉形質転換(EMT)可視化細胞を用いた薬剤スクリーニングシステムを開発しました。EMTは治療抵抗性の原因の1つと考えられています。このEMTの動的イメージング技術を用いて、癌の薬剤耐性のメカニズムの解明や、その阻害剤の開発を進めています。
上皮間葉形質転換(EMT)可視化細胞を用いた薬剤スクリーニングシステムを開発しました。EMTは治療抵抗性の原因の1つと考えられています。このEMTの動的イメージング技術を用いて、癌の薬剤耐性のメカニズムの解明や、その阻害剤の開発を進めています。治療部門
交流磁場と磁性ナノ粒子による癌細胞温熱療法の開発を進めています。
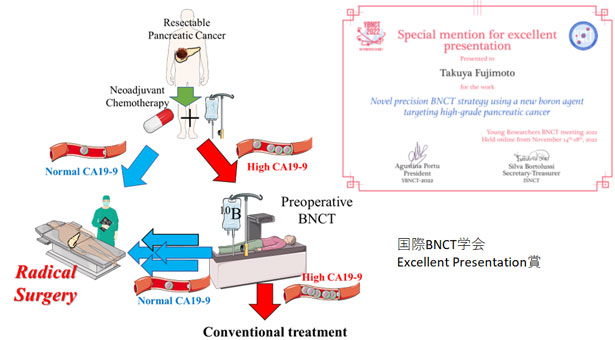
また、中性子医療研究センターと共同で、膵癌を対象とした、ホウ素中性子捕捉療法(BNCT)の前臨床研究を開始しました。
特に、腫瘍マーカーの高い難治性膵癌の治療を目指しており、国際BNCT学会で高い評価を得ています。膵癌を標的としたホウ素薬剤創薬
論文発表
- 1.Hata N, Shigeyasu K, Umeda Y, et al. Adar1 is a promising risk stratification biomarker of remnant liver recurrence after hepatic metastasectomy for colorectal cancer. Scientific reports 2023;13:2078.
- 2.Ieda T, Tazawa H, Okabayashi H, et al. Visualization of epithelial-mesenchymal transition in an inflammatory microenvironment-colorectal cancer network. Scientific reports 2019;9:16378.
- 3.Kagawa T, Matsumi Y, Aono H, et al. Immuno-hyperthermia effected by antibody-conjugated nanoparticles selectively targets and eradicates individual cancer cells. Cell Cycle 2021;20:1221-30.
- 4.Komatsu Y, Shigeyasu K, Yano S, et al. Rna editing facilitates the enhanced production of neoantigens during the simultaneous administration of oxaliplatin and radiotherapy in colorectal cancer. Scientific reports 2022;12:13540.
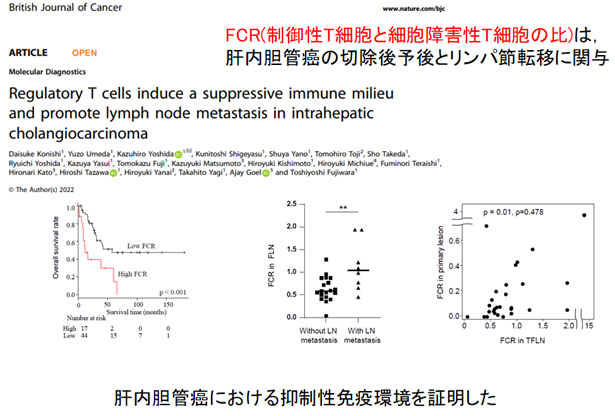
- 5.Konishi D, Umeda Y, Yoshida K, et al. Regulatory t cells induce a suppressive immune milieu and promote lymph node metastasis in intrahepatic cholangiocarcinoma. British journal of cancer 2022;127:757-65.
- 6.Matsumi Y, Kagawa T, Yano S, et al. Hyperthermia generated by magnetic nanoparticles for effective treatment of disseminated peritoneal cancer in an orthotopic nude-mouse model. Cell Cycle 2021;20:1122-33.
- 7.Shigeyasu K, Okugawa Y, Toden S, et al. Azin1 rna editing confers cancer stemness and enhances oncogenic potential in colorectal cancer. JCI insight 2018;3.
- 8.Takahashi K, Shigeyasu K, Kondo Y, et al. Rna editing is a valuable biomarker for predicting carcinogenesis in ulcerative colitis. Journal of Crohn's & colitis 2023;17:754-66.
- 9.Takeda S, Shigeyasu K, Okugawa Y, et al. Activation of azin1 rna editing is a novel mechanism that promotes invasive potential of cancer-associated fibroblasts in colorectal cancer. Cancer letters 2019;444:127-35.
- 臨床応用解剖
-
ご献体による外科手術手技実習は、日本外科学会と日本解剖学会のガイドラインが制定され、これを遵守する形で、本邦では2012年から可能になりました。同年から開始した臨床応用解剖も2022年は10年の節目の年となりました。
しかしながらCOVID-19のため2020年度はコロナでほぼ全コース中止、2021年度もコロナ禍での縮小開催となりましたが、2022年度(2023年1-3月)は全国の公募を基本的に再開し、コロナ前とほぼ変わらない実習を行うことができました。参加いただいた先生方も最終的には全国幅広い地域から11都府県20施設70名とコロナ前と比較しても過去最高の参加人数となりました。全国からの参加者の分布と学外講師
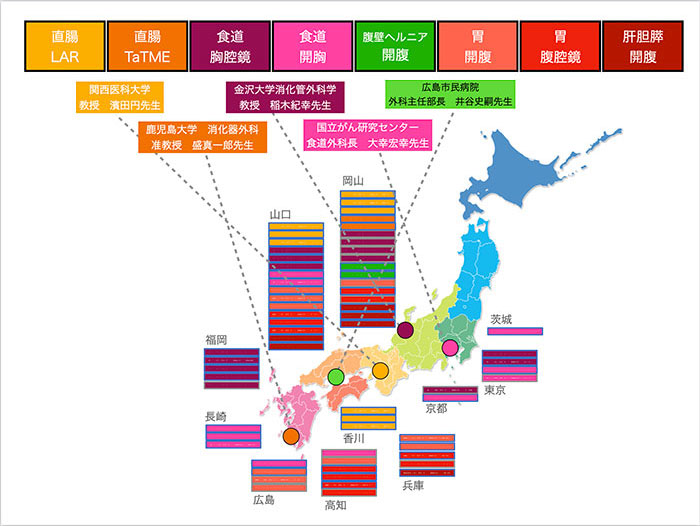
消化器外科手術における基本解剖を理解し、合併症の少ない安全な手術手技の習得を目的として、2022年度は以下の8つのコースを展開いたしました。
(1)腹腔鏡下低位前方切除・側方郭清に 必要な手技および解剖知識の習得
(2)胸腔鏡下食道切除に必要な手技・解剖知識の習得 (基本手技からトラブルシューティングまで)
(3)taTMEに必要な 手技および解剖知識の習得
(4)腹腔鏡下胃切除術・胃全摘術に おける郭清・再建手技の習得 ~ 再建手技について語ろう ~
(5)食道手術に必要な縦隔解剖知識の習得 (開胸基本手技からトラブルシューティングまで)
(6)腹壁瘢痕ヘルニアに対する Componets separation法に 必要な手技および解剖知識の習得
(7)開腹胃切除術に必要な基本手技と解剖学的知識の習得
(8)標準的肝切除/膵切除から高難度手術まで - 手術手技および解剖知識の習得 -
告知ポスターの詳細はホームページ(https://www.mdps.okayama-u.ac.jp/event/220117/)から参照いただくことができます。実践的なトレーニングの様子
(写真はTaTMEコース)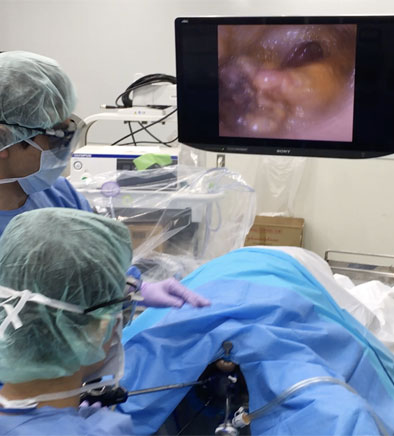 (1)から(4)のコースは腹腔鏡のエキスパートコースであり、それぞれの領域での内視鏡技術認定医取得を目指す外科専門医取得後の7〜12年目の中堅外科医および、さらに高難度の手術を目標とする卒後12年目以上の指導医・専門医を対象とし、(5)から(8)のコースは開腹・開胸のよりベーシックな内容のコースであり、3年目から6年目までの後期研修医から外科専攻医を主な対象としました。それぞれの領域で全国的に著名な講師を招聘することを原則としており2022年度はそれぞれの領域で日本を代表する学外講師を招いており、非常に密度の濃いトレーニングを開催いたしました。エキスパートコースにおいては、3Dフレキシブルスコープ、エアシール 、自動縫合器、エネルギーデバイスなど最新の機器を準備し、ほぼ実臨床と同様の実践的な環境を再現しました。このコースの目的は、普段見ることのできない深部の解剖を含めた手術解剖をより深く理解し、場合によってはトラブルシューティングの知識を含めて、より安全な手技を獲得いただくことでした。実際にエキスパートコースにご参加いただいた先生方には、「普段確認できない解剖が理解できた」「明日からの臨床に役立つ内容であった」というご感想も多くいただいております。
(1)から(4)のコースは腹腔鏡のエキスパートコースであり、それぞれの領域での内視鏡技術認定医取得を目指す外科専門医取得後の7〜12年目の中堅外科医および、さらに高難度の手術を目標とする卒後12年目以上の指導医・専門医を対象とし、(5)から(8)のコースは開腹・開胸のよりベーシックな内容のコースであり、3年目から6年目までの後期研修医から外科専攻医を主な対象としました。それぞれの領域で全国的に著名な講師を招聘することを原則としており2022年度はそれぞれの領域で日本を代表する学外講師を招いており、非常に密度の濃いトレーニングを開催いたしました。エキスパートコースにおいては、3Dフレキシブルスコープ、エアシール 、自動縫合器、エネルギーデバイスなど最新の機器を準備し、ほぼ実臨床と同様の実践的な環境を再現しました。このコースの目的は、普段見ることのできない深部の解剖を含めた手術解剖をより深く理解し、場合によってはトラブルシューティングの知識を含めて、より安全な手技を獲得いただくことでした。実際にエキスパートコースにご参加いただいた先生方には、「普段確認できない解剖が理解できた」「明日からの臨床に役立つ内容であった」というご感想も多くいただいております。膵頭十二指腸切除の実習風景
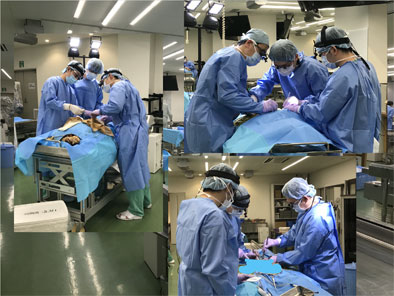 大腸領域で行なったTaTMEは、肛門からの単孔式手術での骨盤解剖を学ぶコースであり、こうした高難度手術においてCSTは初執刀前にかならず経験しておくべきトレーニングの一つとして位置付けられています。頭頸部領域ではすでに高難度術式の施設認定基準の一つしてCSTが必須になっている術式もあります。消化器外科領域ではまだそうした分野はありませんが、将来を見据えた高難度手術の安全な導入という観点からもCSTを継続して参りたいと考えております。
大腸領域で行なったTaTMEは、肛門からの単孔式手術での骨盤解剖を学ぶコースであり、こうした高難度手術においてCSTは初執刀前にかならず経験しておくべきトレーニングの一つとして位置付けられています。頭頸部領域ではすでに高難度術式の施設認定基準の一つしてCSTが必須になっている術式もあります。消化器外科領域ではまだそうした分野はありませんが、将来を見据えた高難度手術の安全な導入という観点からもCSTを継続して参りたいと考えております。
肝胆膵領域では、若手の外科医を対象としてPDのプログラムを開腹で行なっていただきました。肝胆膵のCSTとしては3年ぶりであり、参加者講師とも熱意のある実習が繰り広げられました。肝胆膵領域はとくにご献体の固定が難しい分野であり、ともすれば胆道系は固定が間に合わず融解してしまう領域ですが、この10年間、固定方法の改良を重ね、かなりCSTに耐えうるご献体の状態が実現できているのではないかと考えます。消化器領域の優良な固定状態も本学におけるCSTの特徴の一つであり、全国の大学から解剖学教室の教員がご献体の固定方法の見学に来られています。
腹壁瘢痕ヘルニアのコースは、他の消化器のコースと比較すると一見地味なコースですが、TAR法を始め、最近ではロボットによる修復なども実臨床では検討され始めている領域で、非常にホットな領域です。確実な腹壁瘢痕ヘルニアの手術には神経生理学を含めた腹壁解剖の理解が必要であり、これを体系的に学ぶことのできる貴重なコースと考えております。さて、10年を経過した岡山大学臨床応用解剖ですが、昨年までの10年のデータをまとめたところ、卒後10年目以上で、かつ内視鏡技術認定未取得の参加者は105名おり、セミナー参加後に内視鏡技術認定を取得した参加者は20名でした。参加者の中での技術認定合格率の内訳は食道領域9.8%、胃領域80%、大腸16.7%、ヘルニア33.3%とどの領域も水準以上の合格率で技術認定を取得されており、とくに胃の領域では参加者の80%が内視鏡技術認定制度に合格しておりました。このコースに参加する方はもともと並並ならぬ熱意があるというバイアスがあるとはいえ、非常に高い水準での合格率となりました。
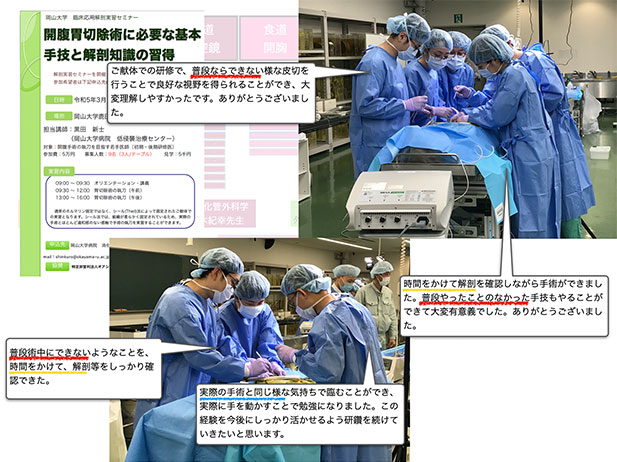
さて、以前は「エルステマーゲン」は外科医の第一歩となるマイルストーン的な手術の位置付けでしてが、腹腔鏡やロボット手術のために、最近では研修医の執刀の機会がほとんどなくなってしまいました。胃切除に必要な基本手術手技、上腹部の解剖は外科医が最初に経験すべきであり、現在では経験する機会の減った大きな開腹下での手技は得られるものも大きいと考えます。まさにノーヴィスコースでは、専攻医もしくは外科専門医取得前後の先生方を対象とし、開腹での基本的な解剖の知識と手技を身につけていただくことを目的として行いました。
参加いただいた先生方からも「ご献体での研修で、普段ならできない様な皮切を行うことで良好な視野を得られることができ、大変理解しやすかったです。」「普段術中にできないようなことを、時間をかけて、解剖等をしっかり確認できた。」との声を多くいただきました。
過去10年で卒後2年目までの参加者は28名であしたが、我々が行う初期研修医に対するCSTは、普段であれば執刀することが難しい開腹手術を時間をかけて解説しながら完投し、外科の魅力を伝えることも一つの目的としており、参加時点ですべての参加者が外科の進路を決定していたわけではありませんが、その後の調査ではすべての参加者が外科系の進路を選択しており、このCSTは初期研修医に対して外科手術の魅力を伝え、我々の熱意を伝える一助を担っており、外科医不足対策の一つになりうる可能性があると考えています。開腹胃切除コースに参加した専攻医の実習風景
岡山大学の消化器外科CSTコースは全国的にも先進的な試みとなっております。参加は完全公募となっており、多くの先生方のご参加を心よりお待ちしております。
- ナノメディシン研究
-
ナノサイズの物質に着目し、がんに対する
新規治療薬の開発を目指しますがん免疫療法
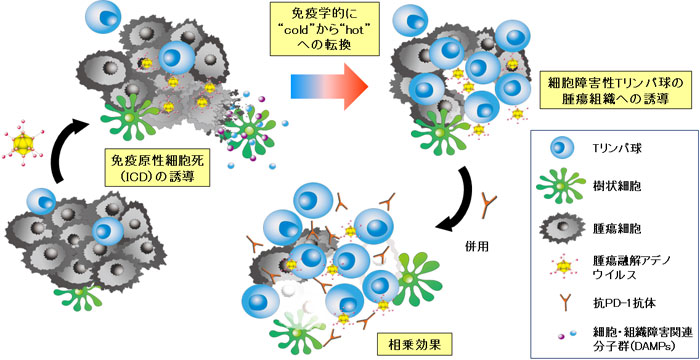
免疫チェックポイント阻害剤の抗PD-1抗体は、既存の治療法では効果を望めない病変に対して治癒をもたらすことができる夢の薬として脚光を浴びています。しかし、その恩恵を受ける患者さんはごくわずかで、その克服のために、他の治療法との併用「複合免疫療法」への期待が高まっています。我々は、腫瘍融解アデノウイルスの腫瘍への局所投与が全身のがん免疫を活性化し、そしてその効果は抗PD-1抗体との併用によりさらに強力になることをマウスの実験で確認しました1)。腫瘍融解アデノウイルスによるがん免疫の活性化は、長期にわたって維持されることが確認できており、これは様々ながんに対する治療戦略に影響を与えるものと考えています。また、胃がんにおいて、腫瘍組織のPD-L1高発現が独立した予後不良因子であることを証明しました2)。
1) Kanaya N, Kuroda S. Mol Ther. 2020
2) Morihiro T, Kuroda S. Sci Rep. 2019腫瘍融解アデノウイルスと抗PD-1抗体との複合免疫療法
細胞外小胞(エクソソーム)
腫瘍融解アデノウイルス含有エクソソーム
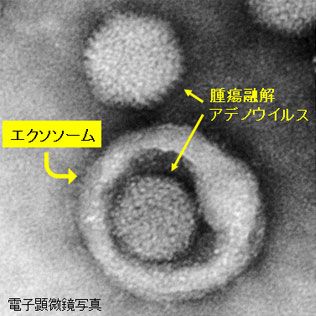 エクソソームは、細胞から分泌される直径100nm前後の小胞で、細胞間の情報伝達の役割を担っているものです。我々は、腫瘍融解アデノウイルスの治療効果におけるエクソソームの関与に着目して研究を行っています。腫瘍融解アデノウイルスは、腫瘍への局所投与により遠隔転移部における治療効果(アブスコパル効果)を発揮することがあります。これには一般的にがん免疫の活性化が関与していると考えられていますが、我々は、ウイルスの投与後に腫瘍から分泌されるエクソソームが、遠隔転移部へのウイルスの運搬に関与し、それがウイルス治療によるアブスコパル効果の一因であることを確認しました3)。また、エクソソームの転移形成への関与やリキッドバイオプシーへの可能性にも着目して研究を進めています。
エクソソームは、細胞から分泌される直径100nm前後の小胞で、細胞間の情報伝達の役割を担っているものです。我々は、腫瘍融解アデノウイルスの治療効果におけるエクソソームの関与に着目して研究を行っています。腫瘍融解アデノウイルスは、腫瘍への局所投与により遠隔転移部における治療効果(アブスコパル効果)を発揮することがあります。これには一般的にがん免疫の活性化が関与していると考えられていますが、我々は、ウイルスの投与後に腫瘍から分泌されるエクソソームが、遠隔転移部へのウイルスの運搬に関与し、それがウイルス治療によるアブスコパル効果の一因であることを確認しました3)。また、エクソソームの転移形成への関与やリキッドバイオプシーへの可能性にも着目して研究を進めています。
3) Kakiuchi Y, Kuroda S. Mol Ther. 2021薬物送達(ドラッグデリバリー)
腫瘍融解アデノウイルス製剤「テロメライシン」は、現在臨床試験段階にある有望や治療薬ですが、一方でその欠点のひとつに、“全身投与ができない”ことがあります。そこで我々は、テロメライシンの遺伝子をリポソームと呼ばれる小胞に入れることで、全身投与可能なテロメライシンの開発につながる研究成果を発表しました4)。近年では、先に述べたエクソソームなどが、ウイルスや他の治療薬のデリバリーにおいて、有用なキャリアとなり得るのではないかと考え研究を進めています。
4) Aoyama K, Kuroda S. Sci Rep. 2017ステルス効果を有する
全身投与可能な腫瘍融解アデノウイルス製剤の開発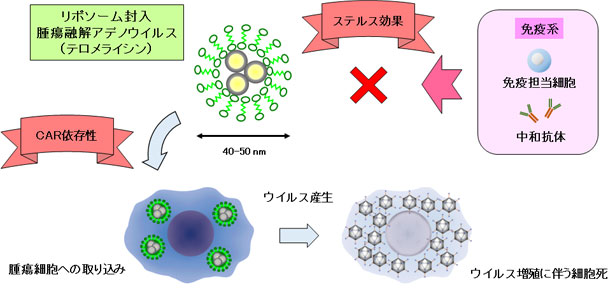
金ナノ粒子
金ナノ粒子は、生体内での安定性に加え、抗体やペプチドなどによる表面修飾が容易であるという特徴を有しており、分子標的薬や遺伝子のキャリアとして使用されています。我々は、HER2陽性胃癌に対する分子標的薬であるトラスツズマブを金ナノ粒子に結合させると、HER2依存的に細胞内への取り込みが増強し、トラスツズマブ抵抗性のHER2陽性胃癌に対しても治療効果を発揮するようになることを証明しました5)。現在はそれを発展させて、抗体薬物複合体との組み合わせの有用性に関して検討を行っています。
5) Kubota T, Kuroda S. Nanomedicine. 2018金ナノ粒子を使用した
トラスツズマブ抵抗性
HER2陽性胃がんに有効な薬剤の開発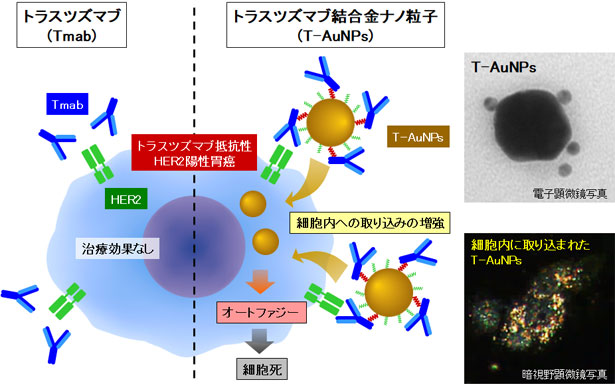
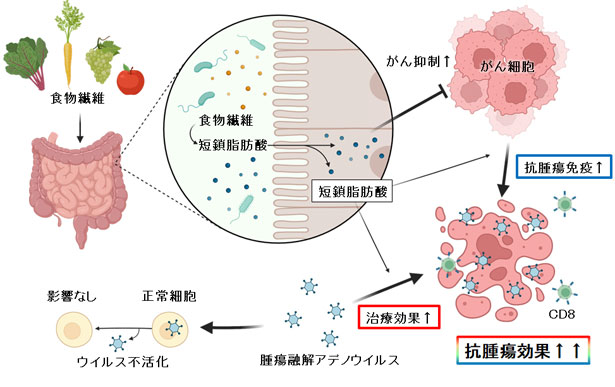
腸内細菌
以前より腸内細菌の様々な疾患への関与が指摘されていますが、近年、がんの発生や治療(特に免疫治療)への影響が報告されるようになってきました。我々は現在、腸内細菌の代謝産物のひとつである短鎖脂肪酸に着目し、短鎖脂肪酸と腫瘍融解アデノウイルスとの併用効果に関して検討を行っています。
短鎖脂肪酸と腫瘍融解アデノウイルスとの併用効果
- がん腹膜播腫治療研究
-
腹膜播種のメカニズム解明と
新規治療法の開発化学療法や分子標的薬、免疫チェックポイント阻害剤(Immune checkpoint inhibitor: ICI)などの新規治療薬の登場により治療成績が向上した現在でも、膵癌、大腸癌、卵巣癌、胃癌などの腹膜播種転移の治療は困難であり、いまだ有効な治療法は確立されていません。
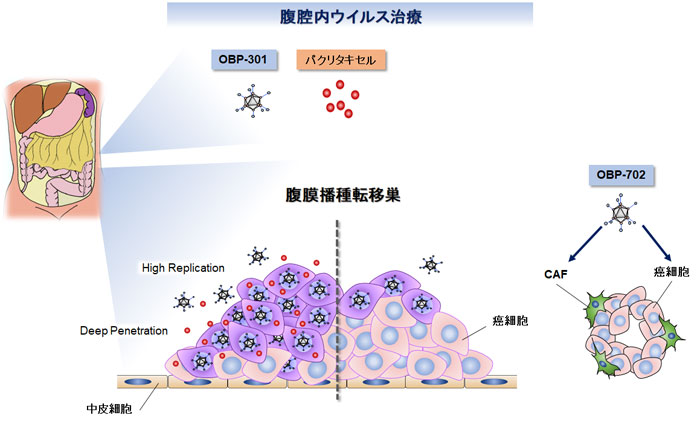
近年、卵巣癌や胃癌の腹膜播種に対して、腹腔内化学療法の有効性や可能性が報告されており、我々は、腹膜播種転移における腹腔内がん微小環境の解明と、腹腔内治療による新規治療法の開発をめざして研究を行っています。① 腹腔内ウイルス治療
当教室で開発された腫瘍融解アデノウイルスを腹腔内に投与することにより、腹膜播種を選択的かつ効果的に治療する方法です。パクリタキセルなどの抗癌剤との併用による相乗効果を動物実験にて確認しています。また、癌関連線維芽細胞(cancer-associated fibroblast: CAF)にも作用し、より強力な抗腫瘍効果を示したり、腹腔内投与することにより腹腔内の抗腫瘍免疫を活性化し、ICIとの相乗効果についても確認しており、今後臨床応用を目指して研究を進めています。
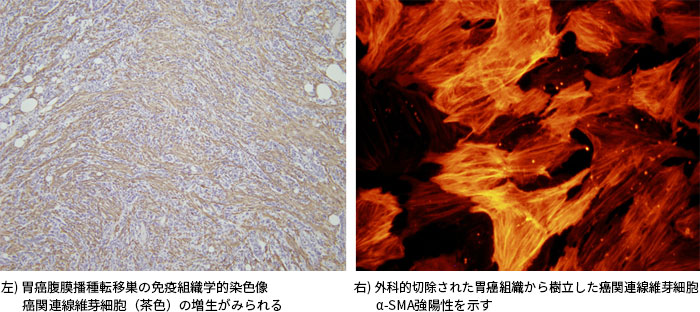
② 腹膜播種メカニズムの解析
切除した腹膜播種巣や腹水などの臨床検体を用いた解析では、癌細胞が腹膜へ生着し増殖するためにCAFや癌関連マクロファージ(tumor-associated macrophage: TAM)が関わっており、また腫瘍促進的なサイトカインを分泌することにより治療抵抗性や抗腫瘍免疫の抑制に関わっていることが今までの研究でわかってきました。さらに我々は、切除した胃癌組織からCAFを樹立して解析を行った結果、CAFは正常の線維芽細胞と比べて化学療法抵抗性や癌促進的なサイトカイン分泌が上昇していることもわかりました。腹膜播種形成における背景胃粘膜構造の変化や腹膜の中皮細胞の変化についても解析しており、新たな治療ターゲットを探索しています。
現在我々は、岡山大学理学部や国立がん研究センターなどの研究施設と協力しながら研究を進めており、将来難治であるがん腹膜播種で苦しむ患者さんの一筋の光となるような治療法の開発を目指して研究を進めています。
